SIFAT-SIFAT PERIODIK UNSUR
Hallo sobat Artikel Pandai, semoga dengan membaca artikel admin dibawah ini dapat menjadikan kita semua menjadi pandai dan berwawasan luas.kali ini admin menulis artikel pandai mengenai sifat-sifat periodik unsur. Silahkan dibaca dan semoga bermanfaat.1. Golongan
Golongan adalah lajur tegak yang terdapat dalam sistem periodik. Pada sistem periodik modern terdapat 8 golongan utama dan 8 golongan transisi. Unsur-unsur dalam satu golongan mempunyai sifat mirip karena elektron valensinya sama. Golongan-golongan tersebut dijelaskan sebagai berikut.Golongan (Nama Golongan) Unsur-unsurnya
IA (alkali) H, Li,Na, K, Rb, Cs, Fr
IIA (alkali tanah) Be, Mg, Ca, Sr, Ba, Ra
IIA (alumunium) B, Al, Ga, In, Ti
IVA (karbon) C, Si, Ge, Sn, Pb
V5 (nitrogen) N, P, As, Sb, Bi
VIA (kalkogen) O, S, Se, Te, Po
VIIA (halogen) F, Cl, Br, I, At
VIIIA (gas mulia) He, Ne, Ar, Kr, Xe, Rn
IB-VIIIB (transisi) Cu, Ag, Au, Zn, Cd, Hg, Dan Sterusnya
2. Periode
Periode adalah lajur horizontal dalam sistem periodik. Unsur-unsur yang menempati lajur horizontal dalam sistem periodik dikelompokkan dalam satu periode. Pada sistem periodik modern terdiri dari 7 periode yaitu sebagai berikut.
Periode Jumlah Unsur
1 (periodde sangat pendek) 2 unsur
2 (periode pendek) 8 unsur
3 (periode pendek) 8 unsur
4 (periode panjang) 18 unsur
5 (periode panjang) 18 unsur
6 (periode sangat panjang) 32 unsur
7 (periode sangat panjang) 26 unsur, 6 unsur belum dpat di sintetis (berisi 32 unsur)
Periode 6 terdapat 8 unsur (golongan A) 10 unsur (golongan B), dan 14 unsur (golongan lantanida= nomor atom 58-710). Periode 7 terdapat 2 unsur (golongan A0, & unsur (golongan B) dan 14 unsur (golongan aktinida=nomor atom 90-103)
3. Logam
Unsur-unsur yang termasuk logam antara lain sebagai berikut.- Semua unsur golongan IA, kecuali H
- Semua unsur golongan IIA , IIIB , IVB, VB, VIB, VIIB, VIIIB, IB, IIB
- Semua unsur golongan IIIA, kecuali unsur boron (B)
- Golongan IVA hanya unsur Sn dan Pb
- Golongan VA hanya unsur bismut
Pada sistem periodik terdapat lebih dari tiga perempat unsur logam. Logam mempunyai sifat-sifat sebagai berikut.
- Dapat menghantarkan listrik dan panas
- Mudah dibentuk (ditempa)
- Mengkilap
- Pada suhu kamar berwujud padat
- bersifat reduktor
- Oksidanya bersifat basa
- Titik lelehnya tinggi
4. Nonlogam
Pada sistem periodik, unsur-unsur nonlogam terletak di bagian kanan mulai golongan IVA sampai golongan VIIIA yaitu terdiri dari :- Golongan IVA : hanya unsru C
- Golongan VA : unsur N dan P
- Golongan VIA ; unsur O, S, dan P
- Golongan VIIA ; unsur F, Cl , Br, I, At
- Golongan VIIIA : unsur He, Ne, Ar, Kr, Xe, Rn.
- Tidak dapat menghantarkan listrik dan panas, kecuali karbon
- Sukar dibentuk
- Tidak mengkilap
- Berwujud Padat, cair, dan gas pada suhu kamar
- Bersifat oksidator
- Oksidanya bersifat asam.
- Ada yang bersifat reaktif (golongan VIIA) dan tidak reaktif (golongan VIIIA)
- Titik didih dan titik lelehnya sangat rendah, kecuali karbon
5. Semilogam (Metaloid)
Unsur yang berada pada perbatasan unsur logam dan non logam bersifat semilogam (metaloid). Sifat unsur metaloid kadang-kadang bersifat logam tetapi ada sebagian bersifat non logam, contohnya permukaan mengkilap, titik didih tinggi, seperti logam, dan ada yang massa jenis dan kerapuhannya seperti non logam. Unsur yang termasuk metaloid adalah B, Si, ge, As, Sb, Te, dan Po6. Keteraturan Unsur Pada Sistem Periodik Unsur
Keteraturan sifat unsur-unsur disusun berdasarkan kenaikan nomor atomnya. Keteraturan ini dapat dijelaskan dengan konfigurasi elektron. sifat-sifat unsur bergantung pada konfigurasi elektron, terutama pada jumlah elektron valensinya. Kemiripan sifat unsur segolongan terjadi karena mempunyai elektron valensi sama.Tabel Konfigurasi Elektron Unsru Golongan IA
Unsur
|
Nomor Atom
|
K
|
L
|
M
|
N
|
O
|
H
Li
Na
K
Rb
|
1
3
11
19
37
|
1
2
2
2
2
|
1
8
8
8
|
1
8
18
|
1
8
|
1
|
7. Jari-jari Atom
Jari-jari atom adalah jarak dari inti atom hingga kulit terluarnya. Secara umum dapat diamati bahwa jari-jari atom dalam satu golongan dari atas ke bawah , jari-jari atom semakin bertambah panjang.Dalam satu golongan, dengan bertambahnya nomor atom jumlah kulit elektron bertambah sehingga jarak inti terhadap elektron terluar makin jauh. Hal itu dapat diterangkan pada gambar di samping.
Dalam satu periode, dengan bertambahnya nomor atom dari kiri ke kanan, jari-jari atom semakin kecil. Unsur-unsru dalam satu periode dari kiri ke kanan mempunyai jumlah kulit elektron yang sam, tetapi, muatan inti bertambah sehingga tarikan inti terhadap elektron terluar semakin kuat dan menyebabkan ukuran atom semakin kecil.
Jari-jari ion adalah jari-jari yang menunjukan ukuran ion pada senyawa ion dengan pengukuran difraksi sinar-X. pada jari-jari ion positif, jumlah lintasan ion unsur selalu lebih sedikit dari jumlah lintasan atomnya dengan melepas elektron, sedangkan pada jari-jari ion negatif, jumlah elektron bertambah dengan menangkap elektron.
Hubungan keperiodikan jari-jari atom dan nomor atom sebagai berikut
grafik jari-jari atom dan nomor atom
Jadi, dapat disimpulkan sebagai berikut.
- Dalam satu periode dengan bertambahnya nomor atom, jari-jari makin kecil
- Dalam satu golongan dengan bertambahnya nomor atom, jari-jari makin besar
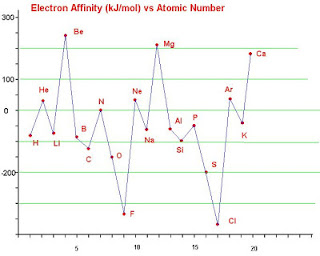
8. Afinitas Elektron
Afinitas elektron adalah besarnya energi yang dilepas atau diserap oleh atom netral dalam bentuk gas pada penangkapan satu elektron untuk membentuk ion negatif. jika penangkapan 1 elektron itu dilepas oleh energi dengan tanda afinitas elektronnya negatif akan membentuk ion negatif yang stabil. Jika penangkapan 1 elektron itu diserap energi dengan tanda positif, ion negatif yang terbentuk tidak stabil.Makin negatif harga efinitas elektron, makin mudah atom tersebut menerima elektron dan terbentuk ion stabil.
Contoh : Cl + e- -> Cl- (H= -349 kJ/mol)
artinya 1 mol Cl menangkap 1 mol elektron membentuk 1 mol ion Cl- dengan melepas energi 349 kJ
Dalam satu golongan , semakin kebawah jari-jari atom semakin besar, gaya tarik inti pada lintasan terjauh semakin lemah sehingga tumbukan elektron luar semakin lemah dan semakin sedikit energi yang disebabkan. Jadi, afinitas elektron semakin kecil. Dalam satu periode jari-jari atom semakin kecil, gaya tarik elektron terjauh dari inti makin kuat , dan tumbukan elektron luar makin kuat sehingga semakin besar energi yang disebabkan dan afinitas elektronnya semakin besar. Hubungan antara afinitas elektron dan nomor atom dapat digambarkan dengan grafik berikut.
Jadi, dapat disimpulkan sebagai berikut.
- Dalam satu periode dengan bertambahnya nomor atom, harga afinitas elektron semakin besar.
- Dalam satu golongan dengan bertambahnya nomor atom, harga afinitas elektron semakin kecil.
9. Energi Ionisasi (Potensial Ionisasi)
Energi ionisasi atau potensial ionisasi adalah energi yang diperlukan untuk melepaskan elektron terluar dari atom. Semakin kecil energi ionisasi, maka suatu atom akan semakin mudah melepas elektron. energi ionisasi merupakan ukuran mudah tidaknya suatu atom untuk menjadi ion positif. Semakin sukar suatu atom melepas elektron, maka semakin sukar pula menjadi ion positif.Contoh : 11Na +energi ionisasi --> Na+ + e-
Semakin dekat jarak inti ke atom, jari-jari atom semakin pendek sehingga energi ionisasi makin besar. Berarti, dalam satu golongan dari atas ke bawah , harga energi ionisasi semakin kecil. Dalam satu periode, dari kiri ke kanan muatan inti bertambah besar sehingga perlu energi yang banyak untuk melepas elektron, maka harga ionisasinya makin besar.
Hubungan antara energi ionisasi dan nomor atom dinyatakan dalam grafik berikut.
Namun, terdapat pengecualian energi ionisasi dalam satu periode yaitu unsur-unsur golongan IIA mempunyai energi ionisasi lebih besar dari energi ionisasi golongan IIIA, dan energi ionisasi golongan VA lebih besar daripada golongan VIA.
Jadi, dapat disimpulkan sebagai berikut.
- Dalam satu periode bertambahnya nomor atom, harga energi ionisasi semakin besar.
- Dalam satu golongan bertambahnya nomor atom, harga energi ionisasi semakin kecil.
10. Keelektronegatifan
Keelektronegatifan adalah kecenderungan suatu atom untuk bermuatan negatif atau untuk menangkap elektron dari atom lain. Besarnya keelektronegatifan dapat diukur dengan menggunakan skala Pauling. Harga skala Pauling berkisar antara 0,7-4,0.Unsur-unsur seperiode dari kiri ke kanan, muatan inti atom makin bertambah sehingga gaya tarik inti ke elektron terluar makin bertambah. Akibatnya, jari-jari atom makin kecil energi ionisasi makin besar, afinitas elektron makin besar (makin negatif), dan kecenderungan untuk menarik elektron makin besar.
Jadi, dapat disimpulkan sebagai berikut.
- Dalam satu periode bertambahnya nomor atom, keelektronegatifan makin besar.
- Dalam satu golongan bertambahnya nomor atom, keelektronegatifan makin kecil.
11. Sifat-sifat Logam
Sifat-sifat unsur berhubungan dengan kecenderungan atom untuk melepas elektron. semakin besar jari-jari atom dan semakin kecil energi ionisasi, maka makin mudah melepaskan elektron dan sifat logam makin bertambah.- Dalam satu periode dengan bertambahnya nomor atom, sifat logam semakin kecil.
- Dalam satu golongan dengan bertambahnya nomor atom, sifat logam makin besar.
12. Kereaktifan
Kereaktifan merupakan kecenderungan zat untuk berubah/bereaksi secara kimia. Semakin tinggi kereaktifan suatu zat, semakin mudah untuk bereaksi.Kereaktifan unsur logam dan nonlogam berbeda. Pada unsur logam, semakin mudah suatu unsur untuk melepaskan elektron, maka unsur logam semakin reaktif. Pada unsur non logam, semakin mudah menarik unsur, maka unsur nonlogam semakin reaktif.
- Pada unsur logam, semakin ke bawah maka semakin reaktif.
- Pada unsur non logam, semakin ke atas maka semakin reaktif.